INTRODUCCIÓN
El primer reporte del aislamiento de Mycoplasma directamente de un humano y asociado a una condición patológica ocurrió en 1937. Dienes y Edsall (1935)1 aislaron un microorganismo, probablemente el ahora conocido como Mycoplasma hominis, de un absceso de glándula de Bartholini. El término Mycoplasma (del griego: mykes= hongo y plasma= formado) fue usado hasta 1950.
Los organismos de este género pertenecen a la clase Mollicutes han sido detectados en humanos, animales vertebrados, artrópodos y plantas. Los Mycoplasmas representan los organismos autorreplicativos más pequeños en términos de dimensiones celulares y tamaño del genoma. Su pequeño genoma y sus limitadas habilidades biosintéticas son responsables de muchas de sus características biológicas y sus complejos requerimientos para su crecimiento en medios de cultivo in vitro.2
La carencia de una pared celular rígida en todos los miembros de la clase Mollicutes les impide ser teñidos por Gram, les confiere pleomorfismo a sus células y las hace muy susceptibles a deshidratación; esto último los limita a una existencia parásita en asociación con células eucariotas de sus huéspedes. La ausencia de pared celular, blanco de
agentes antibacterianos como la penicilina y cefalosporinas, le confiere a los Mycoplasmas una resistencia intrínseca a algunas familias de antibióticos.3
Los Mollicutes frecuentemente aislados del tracto genital y potencialmente patógenos son M. hominis, U. urealyticum y M. genitalium. Mycoplasma hominis y Ureaplasma urealyticum son los aislados con más frecuencia. Estas dos especies pueden estar presentes como flora comensal en 40% de la población humana asintomática. Bajo ciertas circunstancias, estos microorganismos se multiplican excesivamente y se han aislado con frecuencia de pacientes con cervicitis, enfermedad inflamatoria pélvica, vaginosis, prostatitis, epididimitis, pielonefritis, cálculos renales, infertilidad; así también en patologías obstétricas como nacimientos prematuros, rotura prematura de las membranas, abortos, corio-amniotitis, fiebre postparto e infecciones neonatales.4-7
El metabolismo de arginina por M. hominis y la actividad de ureasa en Ureaplasmas se han sugerido como factores potenciales de virulencia. Schimke y Barile (1963)8 propusieron que Mh genera ATP por la hidrólisis de arginina dando como productos finales CO2 y NH3. La liberación de amonio en grandes cantidades puede ocasionar depleción de arginina in vitro lo cual resuelta en un efecto citotóxico. Sin embargo, la evidencia directa de que la depleción de arginina por Mh causa efectos tóxicos in vivo aún es incierta. La liberación de NH3 que ocurre por Ureaplasma spp a través de la hidrólisis de urea es mediada por una ureasa muy potente.
La hidrólisis de urea es el medio predominante por el cual estos microorganismos generan atp. La liberación de amonio en el tracto urinario puede causar un incremento en el pH urinario y la precipitación de fosfatos amónico y magnésico, también conocida como estruvitas, que da lugar a la producción de cálculos renales.7, 9
Los Mycoplasmas y Ureaplasmas son generalmente susceptibles a tetraciclinas y quinolonas10-12; sin embargo, aislamientos clínicos de dichos microorganismos han mostrado ciertos niveles de resistencia, debido a la presencia del determinante de resistencia transponible tet (M).13-15
El incremento en la resistencia Mh y Uu a los agentes antimicrobianos actuales ha creado la necesidad de buscar e identificar nuevos agentes antimicrobianos
que permitan combatir a estos microorganismos y por consiguiente las enfermedades que ocasionan.
Se ha reportado previamente el comportamiento de la susceptibilidad y resistencia a antibióticos de los Mycoplasmas aislados de muestras genitales en otros países y recientemente en México (Ciudad de México),16 siendo considerado el Ureaplasma urealyticum como el agente causal más frecuente de uretritis no gonoccócica en el tracto masculino, sólo después de Chlamydia trachomatis.17 La intención en este trabajo es abordar esta problemática en la ciudad de Villahermosa, Tab., con la finalidad de establecer antecedentes que permitan elucidar el comportamiento de los Mycoplasmas en esta ciudad, así como identificar los agentes antimicrobianos más eficaces, ya que surge la pregunta: ¿qué se sabe respecto a la resistencia a antibióticos de los Mycoplasmas genitales?
OBJETIVO
Conocer la susceptibilidad de Mycoplasma hominis y Ureaplasma urealyticum ante diferentes antibióticos de aislamientos clínicos obtenidos en un laboratorio de Villahermosa, Tab. México.
MATERIALES Y MÉTODOS
Muestras. Se evaluaron 156 muestras clínicas positivas a Mycoplasma hominis y/o Ureaplasma urealyticum de exudado cérvico-vaginal y uretral recibidas en Laboratorios Diagnóstica ubicado en la ciudad de Villahermosa Tab., procedentes de pacientes de esta localidad o municipios aledaños, en el periodo comprendido de junio del 2005 a junio del 2006.
Reactivos. Se realizó el análisis de las muestras a través de un kit comercial que permite la identificación y el antibiograma para Mycoplasmas genitales (MycoView®, IVAGEN). Este método utiliza, para el Ureaplasma urealyticum el medio convencional de Shepard a un pH de 6.0 y se apoya en las propiedades metabólicas de la hidrólisis de urea y resistencia a lincomicina y para Mycoplasma hominis; es un medio líquido a un pH de 7.2 y se basa en la capacidad de este microorganismo de metabolizar arginina y su resistencia a la eritromicina. El crecimiento de ambas especies se identificó a una concentración de 104 Unidades Formadoras de Color (CCU/ml) por cambio de color del indicador rojo de fenol, debido a un incremento del pH, de amarillo-naranja a rojo o rosa, en un periodo de 18 horas.
Los antibióticos y concentraciones que se evaluaron son: roxitromicina (4 µg/ml), azitromicina (4 µg/ml), josamicina (4 µg/ml), minociclina (4 µg/ml), doxiciclina (8 µg/ml), ofloxacina (4 µg/ml), norfloxacina (2 µg/ml).

Análisis estadístico. Se realizó un estudio retrospectivo, transversal y observacional de muestras con crecimiento positivo a Ureaplasma urealyticum, Mycoplasma hominis u ambos, de los resultados obtenidos en la base de datos Lab2000, del periodo de tiempo mencionado.
RESULTADOS
De un total de 156 muestras positivas, 9% (n=14) resultó positivo sólo para Mycoplasma hominis, 53% (n=83) sólo para Ureaplasma urealyticum y 38% (n=59) positivo
para ambos.
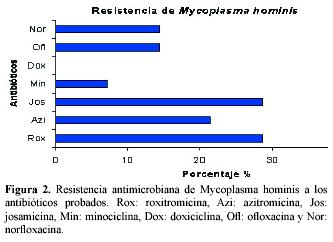
Mycoplasma hominis obtuvo la mayor resistencia a josamicina y roxitromicina con 28.57% para cada uno, siguiendo azitromicina, con 21.43%; mientras que los antimicrobianos más susceptibles fueron doxiciclina y minociclina, con porcentajes de resistencia de 0 y 7.14, respectivamente; y las fluoroquinolonas ofloxacina y norfloxacina, con 14.29%, cada una.
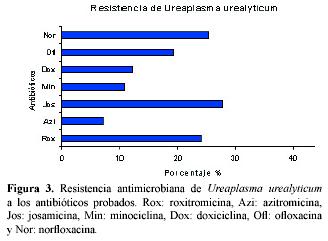
Para Ureaplasma urealyticum se obtuvo la mayor resistencia también para josamicina, con 27.7%, seguido de las fluoroquinolonas, con 25.3% para norfloxacina, y 19.28% para ofloxacina. Para roxitromicina se encontró 24.1%. Los antibióticos en los que se observó mayor susceptibilidad para este microorganismo fueron: azitromicina, minociclina y doxiciclina con porcentajes de resistencia de 7.23, 10.84 y 12.05, respectivamente.
Los aislamientos mixtos (Mycoplasma hominis y Ureaplasma urealyticum) mostraron en general mayor resistencia a todos los antibióticos, con valores de: 86.44% para roxitromicina, 67.80% para norfloxacina y josamicina, 62.71% para azitromicina y 57.63% para ofloxacina. La mayor susceptibilidad se encontró a doxiciclina y minociclina, con porcentajes de resistencia de 28.81 y 30.51, respectivamente.

DISCUSIÓN
La infección por Mycoplasmas genitales representa un problema de salud en México se ha reportado una prevalencia de estos microorganismos de 3.9%, 15.8%, 20.1% y 31%.16, 18-20
La variabilidad observada para la prevalencia de estos microorganismos también se puede observar en los trabajos reportados en otros países donde la prevalencia es de 44.75% en China21 y de 54.9% en Turquía.22 Se considera que M. hominis tiene una prevalencia de 20-50% y U. urealyticum de 40-80%.16, 23
En nuestro trabajo se observó una prevalencia de 9% para Mh, de 53% para Uu y 38% de aislamientos mixtos. Esto concuerda con lo reportado por otros autores, donde la prevalencia de Uu está por encima de Mh y también de los aislamientos mixtos.16, 18, 22, 24 No así con lo reportado por Ramírez,18 donde la mayor prevalencia observada es referida a Mh.
Al analizar la resistencia a los antibióticos probados, se observó que Mycoplasma hominis fue más resistente a roxitromicina y a josamicina, similar a lo reportado por Bebear, en Francia;17 Karabay, en Turquía,22 y Facundo, en México,16 y totalmente sensible a Doxiciclina, observándose nula resistencia ante este antibiótico. Esto último concuerda con lo reportado por Zuo, y Huang, en China; Krausse and Ullman, en Alemania y Karabay, en Turquía.21, 22, 25, 26 Se puede considerar a la doxiciclina como un excelente tratamiento empírico, por lo pronto con esta población para este patógeno.
La resistencia de Ureaplasma urealyticum a los antibióticos probados fue encabezada por josamicina y precedida por norfloxacina, presentando esta última un porcentaje de resistencia de 25.30%. Este valor está por encima de lo reportado por otros autores donde la resistencia a este antibiótico está alrededor de 5.9-7.4%16, 22 Los antibióticos en los que se presentó mayor susceptibilidad fueron azitromicina y doxiciclina. La sensibilidad a la doxiciclina está de acuerdo con otros autores, pero no así la de la azitromicina, donde los niveles de sensibilidad a estos antibióticos resultaron menores.16, 22
La resistencia observada por los aislamientos mixtos fue a roxitromicina, josamicina y norfloxacina, en ese orden decreciente. Esto concuerda con lo reportado por Karabay, con Zuo y con Facundo,16, 21, 22 quienes reportan que los aislamientos mixtos presentan resistencia a casi todos los antibióticos probados. La mayor sensibilidad en estos aislamientos clínicos fueron para la doxiciclina y la minociclina similar a lo observado por Zuo, sólo para la doxiciclina.21
En la revisión de las 156 muestras clínicas se encontró que sólo 2.56% presentó resistencia a todos los antibióticos, lo cual quedó por debajo de Facundo y colaboradores encontraron 7.2%.16
CONCLUSIONES
La mayor sensibilidad se encontró para la doxiciclina y la minociclina, cuando se trata de aislamientos puros a Mycoplasma hominis, y llegó a tener en este último inclusive 0% de resistencia.
Sin embargo, aunque la doxiciclina es un antibiótico de amplio uso en la población mexicana y es el tratamiento de elección para la uretritis y cervicitis no gonoccócica, de acuerdo con el centro de control y prevención de enfermedades de Estados Unidos (2002),27 Falk y colaboradores28 demostraron que este antibiótico no es suficiente para la erradicación de los Mycoplasmas genitales y que el tratamiento más efectivo es a base de azitromicina, lo cual concuerda con los resultados aquí obtenidos en los aislamientos a Ureaplasma urealyticum. Sin embargo, en nuestro estudio, la doxiciclina demostró ser de mayor susceptibilidad en aislamientos puros de Mycoplasma hominis.
La josamicina es la que presentó la resistencia más alta para los aislamientos solos de: Mycoplasma hominis y Ureaplasma urealyticum. No así en los cultivos mixtos en los que la roxitromicina fue la de resistencia mayor.
Es importante considerar la posibilidad de otros antibióticos como posibles candidatos contra estos microorganismos. De acuerdo con esto, Kenny y colaboradores encontraron que Mycoplasma hominis y Ureaplasma urealyticum son más susceptibles a nuevas glicilciclinas (GAR-936) y quinispristina-dalfopristina, respectivamente.
BIBLIOGRAFÍA
1. Dienes L. and G. Edsall. Observations on the L-organism of Klieneberger. Proc. Soc Exp. Biol. Med. 1937. 36: 740-744.
2. Waites KB, Katz B, Schelonka RL. Mycoplasmas and ureaplasmas as neonatal pathogens. Clin Microbiol Rev. 2005.Oct; 18(4): 757-89. Review.
3. Kenny GE, Cartwright FD. Susceptibilities of Mycoplasma hominis, M. pneumoniae, and Ureaplasma urealyticum to GAR-936, dalfopristin, dirithromycin, evernimicin, gatifloxacin, linezolid, moxifloxacin, quinupristin-dalfopristin, and telithromycin compared to their susceptibilities to reference macrolides, tetracyclines, and quinolones. Antimicrob Agents Chemother. 2001. Sep; 45(9): 2604-8.
4. Taylor-Robinson D, McCormack WM. The genital mycoplasmas. N Engl J Med. 1980. May 8; 302(19): 1063-7. Review.
5. Mardh PA. Mycoplasma hominis - a neglected human pathogen. Eur J Clin Microbiol. 1983. Aug; 2(4): 303-8. Review. No abstract available.
6. Plummer DC, Garland SM, Gulbert GL. Bacteraemia and pelvic infection in women due to Ureaplasma urealyticum and Mycoplasma hominis. Med J Aust. 1987. Feb 2; 146(3): 135-7.
7. Grenabo L, H Hedelin, and S Pettersson. Urinary infection stones caused by Ureaplasma urealyticum: a review. Scand. J. Infect Dis Suppl. 1988. 53: 46-49.
8. Schimke RT, Barile MF. Arginine metabolism in pleuropneumonia-like organisms isolated from mammalian cell culture. J Bacteriol. 1963. Aug; 86: 195-206.
9. Ligon JV, Kenny GE. Virulence of ureaplasmal urease for mice. Infect Immun. 1991. Mar; 59(3): 1170-1.
10. Kenny GE, Hooton TM, Roberts MC, Cartwright FD, Hoyt J. Susceptibilities of genital Mycoplasmas to the newer quinolones as determined by the agar dilution method. Antimicrob Agents Chemother. 1989. Jan; 33(1): 103-7.
11. Arai S, Gohara Y, Kuwano K, Kawashima T. Antimycoplasmal activities of new quinolones, tetracyclines, and macrolides Mycoplasma pneumoniae against Antimicrob Agents. Chemother. 1992. Jun; 36(6): 1322-4.
12. Hannan PC. Comparative susceptibilities of various AIDS-associated and human urogenital tract Mycoplasmas and strains of Mycoplasma pneumoniae to 10 classes of antimicrobial agent in vitro. J Med Microbiol. 1998. Dec; 47(12): 1115-22.
13. Roberts MC, Koutsky LA, Holmes KK, LeBlanc DJ, Kenny GE. Tetracycline-resistant Mycoplasma hominis strains contain streptococcal tetM sequences.Antimicrob. Agents Chemother. 1985. Jul; 28(1): 141-3.
14. Roberts MC and Kenny GE. Dissemination of the tetM tetracycline resistance determinant to Ureaplasma urealyticum. Antimicrobial Agents and Chemotherapy. 1986. 40, 551-9.
15. Leng Z, Riley DE, Berger RE, Krieger JN, Roberts MC. Distribution and mobility of the tetracycline resistance determinant tetQ. J Antimicrob Chemother. 1997. Oct; 40(4): 551-9.
16. Fagundo R, Sánchez A, Jáuregui J. Comportamiento antimicrobiano de aislamientos clínicos de Mycoplasma hominis y ureaplasma urealyticum así como la evolución de su resistencia en un periodo de cinco años. Labciencia. 2006. Mayo 14(2).
17. Bebear C, de Barbeyrac B, Dewilde A, Edert D, Janvresse C, Layani MP, Le Faou A, Lefevre JC, Mendel I, Renaudin H, et al. Multicenter study of the in vitro sensitivity of genital Mycoplasmas to antibiotics. Pathol Biol (Paris). 1993 Apr; 41(4): 289-93.
18. Ramírez C, Casanova G, Menoca G; Ortiz, F ; Ahued R. Prevalencia de la infección cervicovaginal por Micoplasma hominis y Ureaplasma urealyticum en pacientes ginecológicas del Instituto Nacional de Perinatología. Enf. Inf y Microbiología. 2004. 24(1), enero-marzo.
19. Narcio Reyes ML, Solórzano Santos F, Arredondo García JL, Calderón Jaimes E, Beltrán Zúniga M. Etiology of cervicovaginal infection in pregnant and non-pregnant patients. Ginecol Obstet Mex. 1989 Feb; 57: 41-6.
20. Rivera JA, Centeno TM, Santellan OM, Rodríguez PN Prevalencia de Ureaplasma urealyticum en mujeres. Rev Mex Patol Clin 2004; 51(1): 33-36.
21. Zuo CX, Huang JH, Chen J, Lu JY, Xiang YP. Female urogenital mycoplasma infection and drug sensitivity status in Changsha. Nan Fang Yi Ke Da Xue Xue Bao. 2006 Jun; 26(6): 831-2, 836.
22. Karabay O, Topcuoglu A, Kocoglu E, Gurel S, Gurel H, Ince NK. Prevalence and antibiotic susceptibility of genital Mycoplasma hominis and Ureaplasma urealyticum in a university hospital in Turkey. Clin Exp Obstet Gynecol. 2006; 33(1): 36-8.
23. Samra Z, Soffer Y, Pansky M. Prevalence of genital Chlamydia and Mycoplasma infection in couples attending a male infertility clinic. Eur J Epidemiol. 1994 Feb; 10(1): 69-73.
24. Guo X, Ye Z, Deng R. Male urogenital tract mycoplasma infection and drug-resistance evolution. Zhonghua Nan Ke Xue. 2004 Feb; 10(2): 122-4.
25. Huang C, Liu Z, Lin N, Tu Y, Li J, Zhang D. Susceptibility of mixed infection of Ureaplasma Urealyticum and Mycoplasma Hominis to seven antimicrobial agents and comparison with that of Ureaplasma Urealyticum infection. J Huazhong Univ Sci Technolog Med Sci. 2003; 23(2): 203-5.
26. Krausse R, Ullmann U. Comparative in vitro activity of fleroxacin (RO 23-6240) against Ureaplasma urealyticum and Mycoplasma hominis. Eur J Clin Microbiol Infect Dis. 1988 Feb;
7(1): 67-9.
27. Centers for disease control and prevention. Diseases characterized by urethritis and cervicitis. Sexually transmitted diseases treatment guidelines. Morbidity mortality weekly. Report. 2002. Vol 15 (No RR-6), 30-42.
28. Falk L, Fredlund H, Jensen JS. Tetracycline treatment does not eradicate Mycoplasma genitalium. Sex Transm Infect. 2003 Aug;
79(4): 318-9.